Gazlarda kısmi basınç nasıl hesaplanır?
Gaz karışımlarında her bir bileşenin oluşturduğu basınca kısmi basınç denir. Dalton'un Kısmi Basınçlar Yasası, toplam basıncın, karışımdaki gazların kısmi basınçlarının toplamına eşit olduğunu belirtir. Bu kavram, gazların davranışlarını anlamada kritik bir rol oynar.
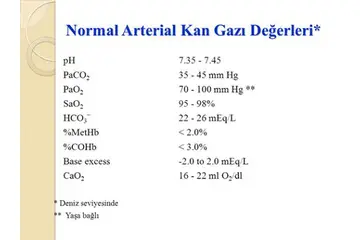
Gazlarda Kısmi Basınç Nedir?Gaz karışımlarında bulunan her bir gazın, toplam basınç altında oluşturduğu basınca "kısmi basınç" denir. Kısmi basınç, belirli bir gazın, karışımdaki diğer gazlara bakılmaksızın, gazın bulundurduğu hacmin tamamında yaratacağı basıncı ifade eder. Bu kavram, Dalton'un Kısmi Basınçlar Yasası ile tanımlanır. Dalton'un Kısmi Basınçlar YasasıDalton'un yasasına göre, bir gaz karışımındaki toplam basınç, karışımdaki her bir gazın kısmi basınçlarının toplamına eşittir. Matematiksel olarak ifade edilirse: Total Basınç (P) = P1 + P2 + P3 +... + Pn Burada P1, P2, P3,..., Pn gazların kısmi basınçlarıdır.Kısmi Basınç Nasıl Hesaplanır? Bir gazın kısmi basıncını hesaplamak için aşağıdaki adımları izleyebilirsiniz:
Örnek Uygulama Örnek olarak, bir karışımda 2 mol oksijen (O2) ve 3 mol azot (N2) bulunsun. Toplam mol sayısı 5 mol'dür. Eğer toplam basınç 1 atm ise: - Oksijenin kısmi basıncı: P_O2 = (2 mol / 5 mol) 1 atm = 0.4 atm - Azotun kısmi basıncı: P_N2 = (3 mol / 5 mol) 1 atm = 0.6 atm Görüldüğü gibi, kısmi basınçlar toplam basınca eşittir (0.4 atm + 0.6 atm = 1 atm). Sonuç Kısmi basınçlar, gazların karışım içerisindeki davranışlarını anlama noktasında büyük öneme sahiptir. Dalton'un Kısmi Basınçlar Yasası, gazların davranışlarını tahmin etmek ve çeşitli kimyasal reaksiyonlar gerçekleştirmek için önemli bir araçtır. Kısmi basınçların hesaplanması, fiziksel bilimlerde, mühendislikte ve kimyada birçok uygulama bulur. |
İlk soruyu siz sormak istermisiniz?