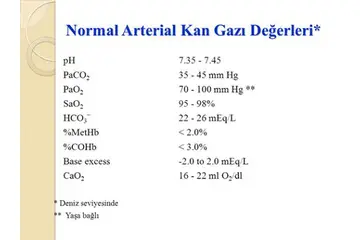
Gazların basıncı 10. sınıfta nasıl hesaplanır?
Gazların basıncı, moleküllerin bir yüzeye çarpması sonucu oluşan kuvvetin alan oranıyla tanımlanır. İdeal gaz yasası, Dalton'un kısmi basıncı gibi temel prensipler sayesinde, basınç hesaplamaları, gazların sıcaklık, hacim ve mol sayısı gibi parametrelerine dayanarak gerçekleştirilebilir.
Gazların Basıncı Gazların basıncı, gaz moleküllerinin bir yüzeye çarpması sonucu oluşan kuvvetin, bu yüzeyin alanına oranı ile hesaplanır. Gazların basıncı, çeşitli fiziksel prensiplere dayanarak farklı durumlarda hesaplanabilir. Bu hesaplamalar genellikle ideal gaz yasası, Dalton'un kısmi basınç yasası ve Avrupa gaz yasası üzerinden yapılır. Aşağıda gazların basıncını hesaplamak için gerekli bazı temel kavramlar ve formüller yer almaktadır. İdeal Gaz Yasası
Basıncı Hesaplama Basıncı hesaplamak için ideal gaz yasasını kullanabiliriz. Örneğin, bir gazın hacmi ve sıcaklığı biliniyorsa, mol sayısını (n) bulduktan sonra basıncı hesaplamak mümkündür. Örnek Hesaplama Bir gazın 10 L hacminde ve 300 K sıcaklığında bulunduğu durumda, 2 mol gazın basıncı nasıl hesaplanır? 1. Öncelikle gereken değerler: - V = 10 L - T = 300 K - n = 2 mol - R = 0.0821 L·atm/(mol·K) 2. İdeal gaz yasası formülünü yerine koyarak basıncı bulalım: \[ P = \frac{nRT}{V} \] \[ P = \frac{2 \times 0.0821 \times 300}{10} = 4.926 atm \] Böylece, bu koşullardaki gaz basıncı yaklaşık 4.93 atm olarak hesaplanır. Dalton'un Kısmi Basınç Yasası Eğer bir gaz karışımımız varsa, her bir gazın basıncı, toplam basınca katkı sağlar. Dalton'un kısmi basınç yasasına göre:
Sonuç Gazların basıncını hesaplamak, fiziksel prensipleri anladığınızda oldukça basittir. İdeal gaz yasasının, gaz karışımlarında Dalton'un yasasının uygulandığı durumlarda, gazların durumu, mol sayısı, sıcaklık ve hacim gibi değişkenler üzerinden hesaplanarak, işleyiş ve sonuçlar daha iyi anlaşılabilir. Gazların basıncını öğrenmek, birçok bilimsel ve mühendislik alanında kritik öneme sahiptir. |
İlk soruyu siz sormak istermisiniz?