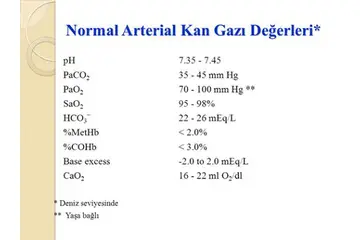
Gazların basıncı nasıl oluşur?
Gaz basıncı, gaz moleküllerinin bir alana uyguladığı kuvveti ifade eder ve moleküllerin çarpışma sıklığına ve hızına bağlı olarak değişir. Sıcaklık, hacim ve molekül sayısı gibi faktörler, gaz basıncını etkileyen önemli unsurlardır. Ideal gaz yasası, bu dinamikleri açıklamak için kullanılır.
Gaz Basıncı Nedir?Gaz basıncı, bir gazın belirli bir alana uyguladığı kuvvetin ölçüsüdür. Gaz moleküllerinin hareketleri, çarpışmaları ve etkileşimleri sonucunda oluşur. Bu basınç, gaz moleküllerinin çarpma frekansı ve hızına bağlı olarak değişir. Gaz Moleküllerinin Hareketi Gazlar, moleküllerinin düzensiz bir biçimde dağılmış olduğu ve sürekli hareket halinde bulunduğu bir madde halidir. Gaz molekülleri, sıcaklık arttıkça daha fazla enerji kazanır ve hızlanır. Bu hareket, gaz moleküllerinin bir yüzeye çarpmasıyla basıncı oluşturur.
Ideal Gaz Yasası Gazların basıncı, sıcaklık ve hacim ile ilişkilidir. Ideal gaz yasası, bu üç parametre arasındaki ilişkiyi açıklayan önemli bir denklemdir. Ideal gaz yasası şu şekildedir: PV = nRT Burada; - P: Basınç, - V: Hacim, - n: Mol sayısı, - R: Gaz sabiti, - T: Sıcaklık (Kelvin cinsinden) Bu denklem, gazların davranışını anlamamızda önemli bir rol oynamaktadır. Gazın basıncı artırmak için hacmi azaltabilir veya sıcaklığı artırabilirsiniz. Gaz Basıncının Oluşumunu Etkileyen Faktörler Gazların basıncını etkileyen başlıca faktörler şunlardır:
Gerçek Gazların Davranışı Gerçek gazlar, ideal gaz yasasına tam olarak uymamaktadır. Düşük sıcaklık ve yüksek basınç koşullarında, gaz molekülleri arası çekim kuvvetleri ve moleküllerin hacmi gibi faktörler önemli hale gelir. Bu durum ideal gaz yasasının geçerliliğini azaltır.
Sonuç Gaz bazında, basınç, moleküllerin hareketleri, çarpışmaları ve gazın fiziksel özellikleri ile ilişkilidir. Sıcaklık, hacim ve molekül sayısı, gaz basıncını etkileyen temel faktörlerdir. Ideal gaz yasası, bu etkileşimleri anlamada yardımcı olan temel bir araçtır, ancak gerçek gazlar için bazı sınırlamaları vardır. Gazların basıncını anlamak, birçok bilimsel ve endüstriyel uygulamada kritik öneme sahiptir. |
İlk soruyu siz sormak istermisiniz?