Gazların özellikleri nelerdir ve gaz kanunları nasıl açıklanır?
Gazlar, fiziksel özellikleri ve davranışları açısından oldukça ilginç bir madde halidir. Düşük yoğunluğu, şekilsiz yapısı ve hareketlilikleri gibi özellikleri, gazların çeşitli uygulamalarda nasıl etkileşimde bulunduğunu anlamada kilit rol oynar. Gaz kanunları ise bu tür etkileşimleri matematiksel olarak tanımlar.
Gazların Temel Özellikleri Gazlar, maddenin üç hali arasında en az yoğun olanıdır. Gazlar, belirli bir şekilleri yoktur ve kapladıkları hacim, içerdikleri kabın hacmiyle sınırlıdır. Gazların bazı temel özellikleri şunlardır:
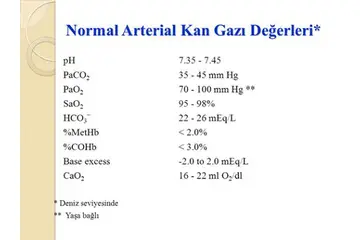
Gaz Kanunları Gazların davranışlarını açıklamak için çeşitli gaz kanunları geliştirilmiştir. Bu kanunlar, gazların sıcaklık, basınç, hacim ve miktar arasındaki ilişkileri tanımlar. En önemli gaz kanunları şunlardır:
Sonuç Gazların özellikleri ve davranışlarını anlamak, birçok bilimsel ve endüstriyel uygulama için kritik öneme sahiptir. Gaz kanunları, bu özelliklerin matematiksel olarak ifade edilmesine olanak tanır. Gazların belirli koşullar altında nasıl davrandığını bilmek, mühendislik, kimya ve fizik gibi birçok alanda önemli sonuçlar doğurur. |
İlk soruyu siz sormak istermisiniz?